Assalamu’alaikum
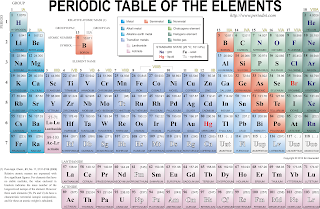
Entri kali ini membahas tentang Tabel Periodik.Yuk mari kita lihat dulu gambar di bawah ini:
 |
| AL-kimya SPU |
Tabel Periodik Sering disebut SPU (Sistem periodik unsur). SPU adalah daftar nama-nama unsur yang disimbolkan dengan huruf alfabet yang disusun secara berkala atau secara terperiodik berdasarkan kesamaan sifat antara unsur yang satu dengan unsur yang lain.
Tabel periodik yang kita gunakan sekarang merupakan tabel periodik modern yang disusun oleh Henry Moesley (1941). tabel ini merupakan hasil penyempurnaan dari tabel periodik jenis sebelumnya yang telah ada. Istilah yang ada dalam
tabel periodik diantaranya:
Deretan unsur-unsur yang tersusun secara vertikal berdasarkan kesamaan jumlah elektron pada kulit terluarnya dan kemiripan sifat.
2. Periode (Period)
Deretan unsur-unsur yang tersusun secara horizontal berdasarkan kesamaan jumlah kulit atomnya. (Kulit atom merupakan tempat elektron berada) dan kenaikan nomor atom
3. Nomor atom (Atomic Number)
Jumlah elektron atau proton dari suatu unsur
4. Massa Atom (Relative Atomic Mass)
Jumlah neutron ditambah jumlah proton atau elektron
Berdasarkan gambar diatas dapat kita lihat

Untuk lebih jelasnya kalian bisa DOWNLOAD software SPU di
http://www.top4download.com/chemistry-101/download-edvabfzh.html
Perlu diperhatikan bahwa warna tiap-tiap unsur dalam tabel periodik diatas yang berbeda-beda merupakan sifat yang dimiliki setiap unsur, hal ini sesuai dengan keteraturan penyusunannya.
Ada dua golongan yang tidak saya bahas yaitu lantanida dan aktinida.
SIFAT PERIODIK UNSUR
Setelah mengatahui Tabel Periodik/ SPU sekarang kita akan membahsa tentang sifat periodik unsur. sebelum itu, pertannyaannya
#apa perbedaan sifat periodik unsur dengan sifat unsur?
jawabannya adalah...
Sifat periodik unsur lebih mengarah pada sifat-sifat unsur yang menyertai keteraturan tabel periodik, atau dengan kata lain, sifat yang ada pada tabel periodik itu sendiri. sedangkan sifat unsur adalah sifat yang dimiliki suatu unsur dalam golongan tertentu (telah dijelaskan diatas).
Pada umumnya Sifat Periodik unsur ada 4 yaitu:
1. Jari-jari atom atomic radius
2. Keelektronegatifan electronegativity
3. Energi Ionisasi ionisation energy
4. Afinitas Elektron electron affinity
Yuk kita lihat dulu gambar dibawah ini!
Dari gambar diatas dapat kita ketahui dari kiri ke kanan dalam satu periode jari-jari atom semakin kecil sedangkan dari atas kebawah dalam satu golongan jari- jari atom semakin besar.
Dari kiri ke kanan jari-jari atom makin kecil karena dalam satu periode jumlah kulit atom sama , sedangkan elektron yang mengisi kulit tersebut bertambah sesuai dengan nomor atomnya, dan jumlah proton dan neutronnya juga bertambah, sehingga gaya tarik menarik antara proton dan elektronnya semakin kuat sehingga jarak antara orbital ke inti atom semakin dekat (jari- jari atom), dan dari atas ke bawah jari-jari atom semakin besar karena dalam satu golongan dari atas kebawah jumlah kulit atom semakin bertambah sehingga jarak antara inti atom dan elektron pada kulit terluar semakin jauh.
Keelektronegatifan unsur adalah Kecenderungan (kemampuan) suatu unsur untuk menerima elektron. dari kiri ke kanan semakin besar karena dalam satu periode jumlah kulit atom tetap sedangkan jumlah elektron pada kulit terluarnnya semakin bertambah sehingga energi yang dibutuhkan untuk melepas elektron tersebut semakin bertambah besar. Sedangkan dari atas kebawah keelektronegatifan atom-atom dalam satu golongan semakin kecil karena dari atas kebawah jarak inti atom ke kulit terluarnya semakin jauh sehingga energi yang digunakan atom untuk melepas elektron pada kulit terluarnya lebih sedikit.
Energi ionisasi adalah energi minimum yang dibutuhkan suatu atom netral dalam bentuk gas untuk melepaskan elektron pada kulit terluar dan membentuk ion positif, dari kiri ke kanan energi ionisai semakin besar karena dalam satu periode gaya tarik antara inti atom dengan elektron pada kulit terluarnya semakin besar sehingga energi yang dibutuhkan untuk menjadi ion positif semakin besar, dan dari atas kebawah energi ionisasi yang dibutuhkan semakin kecil karena dari atas kebawah jarak inti atom ke kulit terluarnya semakin jauh sehingga energi yang digunakan atom untuk melepaskan elektron terluar dan membentuk ion positif lebih sedikit.
Afinitas elektron adalah energi yang dibebaskan suatu atom dalam bentuk gas jika menerima (menarik) elektron. Dari kiri ke kanan dalam satu periode jumlah elektron pada kulit terluar atom-atomnya semakin bertambah sedangkan jumlah kulitnya tetap, sehingga dengan bertmbahnya elektron pada kulit terluar atom-atom dalam satu periode afinitas elektron atom-atom dalam satu periode semakin besar. Sedangkan semakin kebawah kulit terluar atom-atom dalam satu golongan semakin bertambah sedangkan jumlah elektron pada kulit terluarnya tetap sehingga dari atas ke bawah afinitas elektron atom-atom dalam satu golongan semakin kecil. (nilai afinitas elektron bertanda NEGATIF karena "energi" dilepas, karena jika atom menerima energi maka nilainya POSITIF)
Oke, sekian dulu entri tentang tabel periodik kali ini, semoga kalian bisa mengambil manfaat dari entri kali ini. mohon maaf bila ada kata-kata yang salah. nah... untuk entri selanjutnya insyallah akan membahas tentang Konfigurasi Elektron.
Apa sih yang dimaksud ITU??
Kita tunggu entri selanjutnya '.'/
Wassalamu'alaikum...
Kita tunggu entri selanjutnya '.'/
Wassalamu'alaikum...


Tidak ada komentar:
Posting Komentar